Nous savons maintenant de manière certaine que les changements climatique d’une part et d’utilisation des sols d’autre part vont avoir un impact important sur la distribution des espèces dans les décennies à venir. Cela paraît logique : si une plante s’est adaptée à certaines conditions environnementales, comme le climat ou le type d’habitat, et que ces conditions changent ou disparaissent, elle a moins de chance de survie sur le long terme. Mais comment mesurer la vulnérabilité des espèces aux changements futurs ? Comment vont évoluer les distributions des espèces ? Quelles sont les plus vulnérables et qu’ont-elles en commun ? Existe-t-il des espèces qui, au contraire, vont bénéficier des changements environnementaux ? En étudiant les changements attendus dans la distribution d’environ 1700 espèces de plantes de tous types, nous avons pu répondre à ces questions, et les résultats sont pour le moins surprenants…
Cet article est la troisième partie d’une série visant à expliquer et vulgariser ma thèse de doctorat que j’ai préparée aux Conservatoire et Jardin botaniques de la ville de Genève avec l’Université de la même ville, et que j’ai soutenue en Juillet 2022. L’entièreté de ma thèse (en anglais) est disponible, gratuitement, ici : https://archive-ouverte.unige.ch/unige:164478?fbclid=IwAR1tGQFsv27j66PlgjMkpQ_naeYOqTA-7WLX8uxpsUgjGUH8BB7bM-1iJBM.
La première partie traite de l’infrastructure écologique, le cadre conceptuel de mon doctorat, et est disponible en cliquant ici
La seconde partie explique comment modéliser la distribution des espèces et est plutôt importante pour bien comprendre la méthodologie utilisée dans ce chapitre. Elle est disponible en cliquant ici
Pour ce troisième volet, je vais me baser sur un article publié et disponible ici : https://onlinelibrary.wiley.com/doi/full/10.1111/jbi.15132 . Cet article est le cœur de mon travail doctoral, il est donc très dense et très complexe. Je vous présente ici un résumé vulgarisé sans entrer dans les détails méthodologiques qui n’ont pas vraiment d’importance. En revanche, pour bien comprendre le contexte et la méthode derrière les modélisations de distribution d’espèces, je vous conseille de lire (ou d’écouter!) les deux premières parties publiées sur le site. Vous pouvez aussi creuser certaines parties ou accéder aux sources dans l’article scientifique qui a été publié.
Contact : phagophytos@gmail.com

Introduction
Modéliser la distribution d’espèces dans les conditions présentes est déjà assez compliqué et requiert beaucoup de prudence et de compréhension de l’écologie des espèces d’intérêt. Mais quand il s’agit d’appliquer cette méthode à des conditions qui n’existent pas ou pas encore, comme c’est le cas avec le changement climatique, c’est en fait tout bonnement impossible… À moins d’utiliser une petite technique. En effet, nous en avons déjà longuement parlé dans la partie 2 du résumé de ma thèse, les modèles de distribution essaient de calculer la niche écologique réalisée des espèces en se basant sur des variables environnementales et des points d’observation géoréférencés. Sauf que dans notre cas, nous ne savons pas où se trouveront les espèces dans le futur, et nous ne savons pas non plus quel sera exactement le climat de notre aire d’étude. Pour répondre à ces deux problématiques majeures il faut effectuer deux ajustements :
- Travailler avec des scénarios. Comme nous ne connaissons pas le climat futur, il faut viser large et utiliser plusieurs types de modélisations climatiques et plusieurs scénarios. Nous avions déjà parlé de ces scénarios dans cet article. En effet, certains scénarios dits « optimistes », partent du principe que nous allons collectivement drastiquement réduire nos émissions à partir de… il y a quelques années. Aïe…. Bon, ce n’est pas très réaliste mais peu importe, l’idée est avant tout de voir les conséquences d’un scénario extrêmement optimiste où nous redoublons d’effort pour rattraper notre retard (même si vous avez compris, je ne crois pas du tout que nous y arriverons). Il existe aussi des scénarios « pessimistes », dont nous empruntons la voie jusqu’à preuve du contraire, où la concentration en CO2 continue d’augmenter jusqu’à la fin du siècle. Le fait d’utiliser ces deux scénarios « extrêmes » nous donne une idée de ce qu’il devrait se passer, c’est-à-dire quelque chose quelque part entre les deux.
- Étudier la niche écologique complète des espèces. La petite astuce est de déterminer où se trouvent aujourd’hui les régions qui ont un climat similaire à celui de notre zone d’étude (ici Genève et ses alentours) dans le futur. Généralement, sous nos latitudes, il faut regarder du côté du sud de la France, de l’Espagne ou de l’Italie puisque le climat attendu à Genève en 2050 sera similaire à des villes de ces pays. Ensuite, il faut voir si les espèces qui poussent actuellement à Genève sont aussi capables de pousser dans ces régions plus chaudes. En effet, une plante que l’on trouverait de la France jusqu’au Danemark sera bien moins adaptée aux conditions futures plus chaudes qu’une autre que l’on trouverait entre l’Espagne et la Suisse. Cela paraît logique, mais pour le prendre en compte, il faut étudier la distribution des espèces à une échelle spatiale bien plus grande. Dans ce cas, nous avons pris en compte tous les climats d’Europe.
En résumé, nous avons collecté plus de 22 millions d’observations précises de plantes à l’échelle de toute l’Europe pour environ 1700 espèces présentes dans le Grand Genève (territoire transfrontalier entre la France et la Suisse), et nous avons modélisé leur distribution pour la situation présente, ainsi qu’en 2050 dans des scénarios optimistes de changement climatique et dans des scénarios pessimistes. Pour les distributions futures, nous avons aussi pris en compte les changements d’utilisation des sols qui ont été modélisés exprès pour cet exercice (je vous reparlerai prochainement de cette méthode et de son utilité).
Au total et pour chaque espèce, nous avons donc la distribution actuelle ainsi que les distributions futures dans deux scénarios différents. Nous avons aussi accès à d’autres informations comme par exemple le niveau de menace de chacune des espèces ainsi que leur origine (indigène, c’est-à-dire locale, ou exotique, ce qui signifie introduite). Il est donc possible, grâce à l’ensemble de ces informations, de mesurer précisément comment les distributions vont changer entre le présent et le futur en fonction des changements globaux (climatique et d’utilisation des sols), de voir la différence entre les scénarios les plus optimistes et les plus pessimistes, et de comparer ces résultats en fonction du statut de menace ou de l’origine des espèces. Grâce à ce travail, nous pourrons alors répondre aux questions suivantes :
- Est-ce que les espèces aujourd’hui menacées d’extinction sont plus vulnérables aux changement globaux que les espèces dont les populations sont en bonne santé ?
- Existe-t-il une différence de vulnérabilité entre les espèces indigènes et introduites ?
- Quelle menace aura le plus d’impact sur la vulnérabilité des espèces, le changement climatique ou d’utilisation des sols ?
- Quel est l’impact direct de notre (in)action climatique sur la possibilité de survie des espèces dans les prochaines décennies ?
Jolie promesse non ?
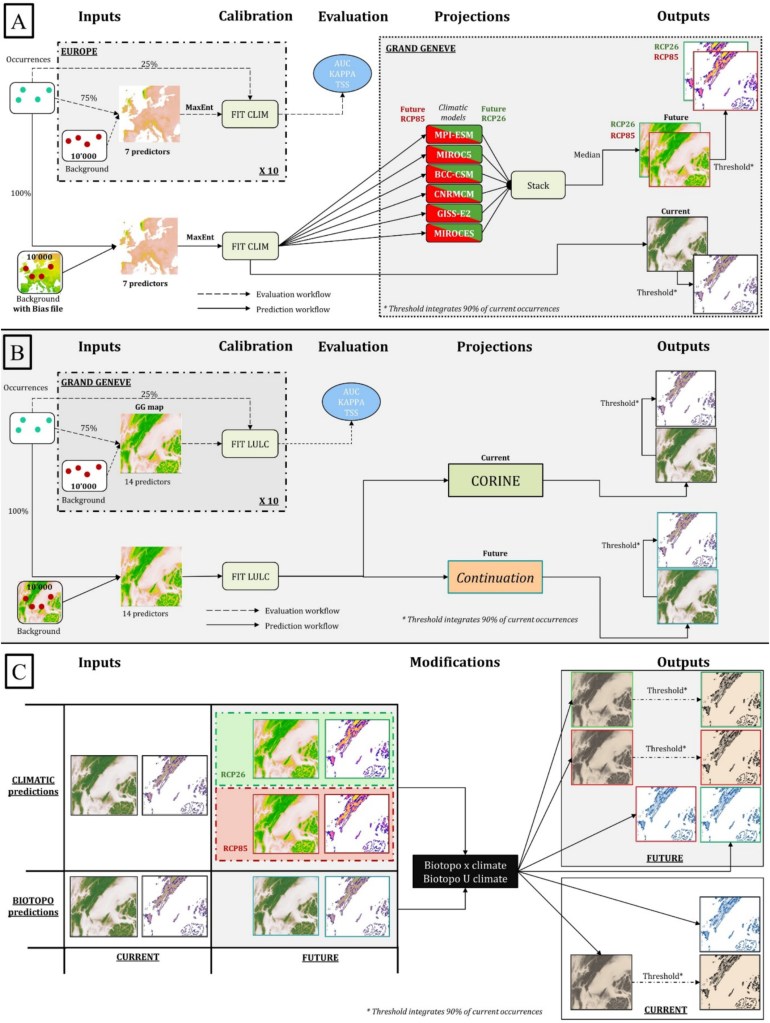
Méthode
Je vous passe la méthodologie utilisée pour modéliser la distribution des espèces, elle est résumée dans la figure ci-dessus et plus largement développée dans la partie 2 du résumé de ma thèse. C’est assez incompréhensible mais n’hésitez pas à me contacter si vous souhaitez des détails. Partons donc du principe que nous avons déjà les résultats, c’est-à-dire les distributions actuelle et futures dans deux scénarios de changement climatique : optimiste et pessimiste. Nous avons alors créé 6 indicateurs pour mesurer comment les changements globaux vont impacter la distribution de nos 1700 espèces de plante.
- La taille de la distribution. Si la distribution future est plus grande que la présente, alors l’espèce sort gagnante des changements globaux. Au contraire, si elle est plus petite, cela signifie qu’elle en train de se raréfier ou de disparaître.
- La qualité du milieu. Il n’y a pas que la taille qui compte, la qualité est tout aussi primordiale :)). Ainsi, une espèce peut avoir une distribution identique dans le futur, mais les changements de conditions environnementales font que la zone est moins propice à sa croissance. Par conséquent, la compétitivité de l’espèce va baisser et la plante peut se raréfier.
- La répartition de l’espèce. Cela représente la distribution relative de l’espèce par rapport à la surface totale de l’aire d’étude. Cet indice est très important car une espèce très rare sur le territoire est d’autant plus vulnérable aux changements de conditions et plus à même de disparaître localement qu’une espèce à la répartition très large.
- La fragmentation. On mesure ici l’évolution de la fragmentation de la distribution des espèces. Si la distribution est plus fragmentée, c’est-à-dire découpée par des zones non habitables, alors l’espèce est plus menacée par les changements de conditions que si elle avait une distribution continue sans obstacle.
- Indice de migration. Si la distribution future se superpose parfaitement avec celle d’aujourd’hui alors l’espèce est moins vulnérable que si elles ne se superposent pas. Dans ce cas, l’espèce doit migrer et s’installer dans de nouvelles zones, ce qui n’est pas toujours facile dans un lapse de temps aussi court. Une migration « forcée » importante est donc globalement négatif pour la pérennité de l’espèce. Au contraire, si les zones actuellement favorables au développement de l’espèce le restent dans le futur, elle n’est pas vulnérable au changement de conditions.
- Le potentiel de colonisation. Si l’espèce est en capacité de coloniser de nouvelles zones dans le futur, cela est plutôt bénéfique pour sa survie et réduit sa vulnérabilité aux changements environnementaux.
Une fois l’ensemble de ces indicateurs calculés, il nous faut pouvoir les résumer pour qu’ils soient plus faciles à comprendre. On crée alors un indice de vulnérabilité globale qui va de 0 pour les espèces qui vont énormément bénéficier des changements globaux (distribution agrandie, qualité du milieu améliorée, habitats mieux connectés etc.), à 9 pour les espèces extrêmement vulnérables (distribution plus petite, qualité moindre, fragmentation accrue etc.). Vous trouverez la méthode exacte de calcul de cet indice dans l’article scientifique. Les résultats sont quelques peu surprenants, essayons de les décortiquer et de les discuter.
Résultats
Distributions actuelle et futures
Les résultats montrent qu’à l’horizon de 2050, 4 espèces de plantes auront disparu de la région genevoise. C’est à la fois peu comparé à notre jeu de données et en même temps, en moins de 3 décennies, c’est énorme. Nous avons aussi remarqué que certaines espèces devraient énormément profiter des changements de conditions comme par exemple l’orchidée méditerranéenne Himantoglossum robertianum ainsi que Gleditsia triacanthos. Ces deux espèces sont bien différentes mais illustrent parfaitement les espèces gagnantes du changement climatique. La première est une plante qui vient des climats chauds méditerranéens, il est donc normal qu’avec la hausse des températures, elle ait davantage de zones habitables à Genève et aux alentours. Elle est d’ailleurs naturellement en train de coloniser la France en remontant vers le Nord, maintenant que l’hiver n’est plus aussi rude qu’avant (s’il fallait une nouvelle preuve du réchauffement climatique). La seconde espèce est un arbre exotique, c’est-à-dire qu’il vient d’une autre région que la nôtre. Dans ce cas, il est natif du sud des Etats-Unis et du nord du Mexique où le climat est plus chaud et plus sec que chez nous. Il est donc parfaitement normal qu’il y trouve son compte avec les changements de conditions.
Les distributions futures seront différentes des actuelles pour la majorité des plantes. Voici quelques résultats en vrac lorsque l’on regarde les valeurs moyennes de notre jeu de données :
- Pas ou peu de différence d’habitabilité entre le présent et le futur, cela signifie que les zones habitables futures seront globalement de qualité similaire à celles habitables aujourd’hui.
- Alors que les espèces indigènes ont aujourd’hui une répartition plus grande dans le territoire, la tendance montre qu’un inversement est en cours : la répartition des plantes indigènes baissent dans le futur alors que c’est l’inverse qui est observé pour les exotiques qui gagnent donc du terrain.
- En lien avec le résultat précédent, l’aire de distribution des espèces locales va globalement baisser, l’intensité étant très variable en fonction des espèces, alors que celle des espèces exotiques va fortement augmenter, d’environ 50 km carré en moyenne pour les scénarios optimistes et d’environ 75 km carré pour les scénarios pessimistes !
- Les espèces indigènes vont devoir migrer pour trouver des habitats favorables, surtout dans les scénarios pessimistes, alors que ce ne sera pas du tout le cas pour les espèces exotiques dont les milieux vont rester favorables à leur développement.
- Le potentiel de colonisation de nouvelles aires est très élevé pour les espèces exotiques alors qu’il est faible pour les espèces locales.
- Enfin, alors que les espèces indigènes vont voir leur aire de distribution se fragmenter de plus en plus dans le future, c’est tout l’inverse qui est observé pour les espèces exotiques.
Vous l’aurez compris, les indices sont globalement (très) négatifs pour les espèces locales, indigènes, alors qu’ils sont (très) positifs pour les espèces exotiques déjà présentes sur le territoire. Autre résultat intéressant, les tendances observées sont toujours accentuées dans les scénarios pessimistes de changement climatique : une espèce en déclin faible dans les scénarios futurs optimistes sera en déclin fort dans les pessimistes, mais l’inverse fonctionne également, une espèce qui bénéficie moyennement des changements globaux dans les scénarios optimistes sera beaucoup plus avantagée dans les pessimistes. On pourrait être tenté de penser que ces résultats ne sont pas si grave et que la disparition d’espèces locales sera contrebalancé par le développement des exotiques. Malheureusement, ce n’est pas si simple et l’on décortique ce sujet plus longuement dans la discussion.


Indice de vulnérabilité
Si l’on regarde la valeur de l’indice de vulnérabilité pour l’ensemble des plantes de notre jeu de données, les résultats confirment une tendance inquiétante mais prévisible : en moyenne, les plantes sont plus vulnérables dans les scénarios pessimistes que dans les scénarios optimistes de changement climatique. Cela signifie que notre capacité à réduire nos émissions de gaz à effet de serre a un impact direct sur la possibilité de survie de plantes à l’échelle locale. Un autre résultat intéressant de cette étude est en réalité un non résultat : il n’y aucune différence de vulnérabilité entre les espèces déjà menacées d’extinction et les espèces dont les populations sont en bonne santé. Ce résultat a plusieurs conséquences : premièrement, les changements climatique et d’utilisation des sols impacteront toutes les espèces, qu’elles soient déjà menacées ou en bonne santé n’y changera rien; deuxièmement, les espèces aujourd’hui en danger d’extinction le sont pour d’autres raisons puisque les changements globaux ne semblent pas nécessairement aggraver la situation et enfin; les statuts de menace de l’IUCN ne nous renseignent pas sur la vulnérabilité des espèces aux changements globaux, et c’est un peu embêtant. Là aussi, on développe un peu plus ces idées dans la discussion car il y a beaucoup à dire.
En gros, les espèces indigènes sont vulnérables aux changements globaux alors que les espèces exotiques bénéficient de ces changements de conditions, et cette tendance est statistiquement plus forte dans les scénarios pessimistes de changement climatique. Pour vous donner une idée de l’ampleur de cette vulnérabilité, plus d’une espèce sur 5 est modérément vulnérable (plus de 350 espèces) dans les scénarios optimistes et cela monte à plus d’une espèce sur 3 (580 plantes) dans les scénarios pessimistes. Si l’on regarde maintenant les espèces extrêmement vulnérables, on a environ 5% (80 espèces) pour les scénarios optimistes et 12% (200 espèces) pour les scénarios pessimistes. Nulle doute qu’une partie d’entre-elle va localement disparaître dans les prochaines décennies. En revanche, nous l’avons vu, les changements de conditions n’ont pas que des effets négatifs et l’on compte aussi beaucoup d’espèces bénéficiaires : un peu moins de 19% des plantes (environ 320 espèces) montrent des bénéfices modérés dans les scénarios optimistes et environ 1 quart des espèces (440 espèces) dans les scénarios pessimistes de changement climatique. Pour les plantes qui vont fortement bénéficier de ces changements, elles représentent un peu moins de 4% des plantes étudiées dans les scénarios optimistes et moins de 7% dans les pessimistes. Nous voyons que le nombre d’espèces avantagées par les changements globaux et le nombre de celles désavantagées sont assez proches, même si nous avons un nombre significativement plus élevé d’espèces vulnérables.
Si les chiffres exacts vous intéressent, je vous invite à lire l’article scientifique dont le lien est posté en haut de cette page 🙂



Discussion
Bon, maintenant que je vous ai noyé sous une montagne de chiffres en bon scientifique que je suis, prenons un peu de recul et résumons les résultats de cette étude avant d’analyser les tendances dans leur globalité.
Les effets des changements globaux varient, certaines espèces y gagnent, majoritairement des espèces exotiques introduites, alors que d’autres, plus nombreuses, y perdent. Les espèces qui y perdent sont majoritairement les espèces locales qui représentent l’écrasante majorité des plantes dominantes de nos forêts, prairies, et milieux humides. Aussi, les effets sont exacerbés dans les scénarios pessimistes de changement climatique que nous suivons actuellement (jusqu’à preuve du contraire, vous connaissez l’adage). Cela signifie que nos actions (et plus précisément notre inaction) pour lutter contre le changement climatique ont un réel impact sur la survie des plantes de nos régions !
Avant de discuter un peu plus de ces résultats et de ce qu’ils signifient, il est toujours bon de rappeler qu’ils ont été obtenus à partir de modèles, qui ne sont, par définition, jamais parfaits. On en parlait d’ailleurs déjà dans le chapitre précédent. Pour vous donner un exemple, on ne peut littéralement pas prédire une catastrophe naturelle qui accélérerait le phénomène (ou pas, s/o le COVID), ou bien l’arrivée au pouvoir d’un-e climatonégationniste qui décide que, finalement, l’écologie et la protection de l’environnement ben on s’en tape. Ici, on ne peut que regarder ce qu’il se passe aujourd’hui et l’extrapoler linéairement dans le futur afin d’avoir une idée de la moyenne de ce qu’il devrait se passer, quand bien même on sait que les changements se font plutôt par marches d’escalier (une énième sécheresse intense et toute une espèce disparaît d’une région d’un coup, par exemple). Aussi, il est toujours bon de rappeler qu’il est très difficile de prendre en compte la résilience des écosystèmes ou les intéractions entre espèces qui peuvent à la fois ralentir les effets des changements globaux car les habitats modifient le climat localement, ou les accélérer drastiquement à cause des liens entre les espèces d’une même chaîne trophique par exemple.
Discutons de deux résultats importants de cette étude.
Tout d’abord, nous avons vu que les espèces indigènes sont globalement vulnérables aux changements globaux alors que les espèces exotiques devraient plutôt en bénéficier. Lorsque l’on regarde les chiffres, on pourrait presque penser que finalement, comme on a grosso modo autant d’espèces vulnérables qu’avantagées, alors tout va s’équilibrer et tout devrait s’arranger. Bon déjà ce n’est pas le cas puisque dans notre jeu de données, nous trouvons une majorité d’espèces vulnérables, mais admettons. Déjà, nous ne sommes pas sûr que les espèces vulnérables et bénéficiaires se trouvent dans les mêmes habitats. Si les plantes qui disparaissent se trouvent majoritairement en prairie, mais que les espèces qui bénéficient des changements globaux se trouvent en forêt, ça ne fonctionne pas. Dans notre cas c’est d’ailleurs ce que l’on observe : les plantes les plus vulnérables vivent dans les prairies subalpines et celles qui vont bénéficier des changements globaux vivent en plaine. Ensuite, et nous en avions déjà parlé dans plusieurs articles, notamment celui-ci, les espèces comme les écosystèmes ont des fonctions qui permettent un certain équilibre du milieu. On ne peut donc pas simplement remplacer une espèce par une autre si leurs fonctions ne sont pas identiques. Prenons un exemple très réel et terriblement résumé. Remplacer un ver-de-terre local qui recycle les nutriments par un vers plat introduit et prédateur a toutes les chances de bousculer les écosystèmes. C’est exactement ce qui en train de se passer avec l’espèce exotique Obama nungara qui est prédatrice des vers-de-terre de chez nous. Deux espèces qui paraissent très similaires (en réalité elles sont plutôt éloignées génétiquement mais c’est pour l’exemple) ne peuvent pas pour autant s’inter-changer. Là où le problème est encore plus grand dans cette étude, c’est bien l’origine des espèces (clin d’œil à Darwin), puisque ce sont les exotiques qui seront avantagées dans le futur, au détriment des indigènes. Et les espèces exotiques n’ont par définition pas évolué dans le nouveau milieu où elles se trouvent et cela peut avoir de lourdes conséquences, notamment à cause de leur manque d’intéraction avec les autres espèces locales. Par exemple, elles peuvent ne pas être mangées, elles ne servent donc pas de nourriture aux animaux et s’extirpent des chaînes trophiques, elles peuvent ne pas être attaquées par les maladies locales qui ne les reconnaissent pas, ce qui leur confère un avantage énorme par rapport aux espèces indigènes, elles peuvent altérer le milieu durablement, modifiant des écosystèmes entiers qui n’étaient pas habitués à leur présence etc. Histoire de finir d’enfoncer le clou, les espèces exotiques de la région sont majoritairement des espèces sélectionnées, introduites et modifiées par les humains pour tout un tas de raisons, généralement esthétiques ou utiles, afin de les garder dans des pots en ville par exemple, mais vraiment pas pour des raisons écologiques qui leur permettraient de remplacer les arbres de nos forêts. Bref, on ne peut pas remplacer des espèces indigènes par des espèces exotiques, surtout pas en si peu de temps, et encore moins si ce sont des espèces que l’on a sélectionnées pour d’autres usages.
On pourrait parler de cette thématique durant une éternité, c’est littéralement un pan entier de recherche en écologie, en restauration des écosystèmes et en conservation, mais je soulève ici juste quelques points de réflexion. Bref, l’autre résultat qui, je pense, est très intéressant, est l’absence de lien entre la vulnérabilité des espèces et les statuts IUCN. Cela signifie que les changements environnementaux, en particulier le changement climatique puisque c’est le moteur principale de la vulnérabilité des espèces dans cette situation, vont affecter de la même manière des espèces rares en danger d’extinction, et des espèces communes dont les populations sont en pleine forme. On pourrait être tenté d’imaginer que le changement climatique pourrait alors aider certaines espèces à recouvrer un peu de force afin de sortir du danger d’extinction. Mais cela signifie surtout autre chose : les espèces aujourd’hui en danger d’extinction, le sont pour d’autres raisons que le changement climatique. Autrement dit, le changement climatique va ajouter une pression supplémentaire à des espèces déjà clairement menacées et il est assez utopique de penser qu’il va pouvoir aider certaines plantes à surpasser les autres problèmes environnementaux majeurs qui les impactent déjà, et à cause desquels elles sont justement en train de disparaître. Ce résultat indique aussi quelque chose d’un peu terrifiant : les statuts de menace que nous avons développé ne prennent pas en compte les changements climatiques. En réalité, et nous en avions déjà parlé dans cet article sur les plantes carnivores, les statuts de menace sont définis en se basant sur l’évolution passée et la situation actuelle des populations. Ils ne se basent absolument pas sur les menaces futures. Et ça c’est un problème : on ne peut pas correctement planifier la conservation des écosystèmes si on ne regarde que les situations passée et actuelle, d’autant plus si l’on considère le temps nécessaire pour étudier les taxons concernés, publier les résultats, changer les statuts de menace, trouver des financements pour mettre en place des mesures environnementales, faire passer les lois nécessaires, appliquer les mesures, les suivre dans le temps et étudier les impactes qu’elles ont eu sur la santé des populations afin de les ajuster etc. Cela prend un temps de dingue, comme dirait l’autre. Au contraire, prendre en compte dans ces statuts de menace la vulnérabilité aux conditions futures pourraient nous aider à prendre de meilleures décisions et plus rapidement !
Voilà tout ce que j’avais à vous dire sur cet article, je trouve personnellement super intéressant de faire ce genre d’étude pour mieux connaître les territoires et les vulnérabilités des espèces qui les peuplent. Ce n’est évidemment pas avec ce genre d’articles scientifiques que l’on est publié dans des revues prestigieuses mais ils produisent pourtant des informations très utiles pour les pouvoirs publiques afin de prendre de meilleures décisions de conservation !
Merci beaucoup et à la prochaine pour le dernier chapitre, lorsqu’il sera publié !


Pour aller plus loin :