Article paru dans la revue N°96 de l’association Dionée publié en 2022
Version audio de l’article disponible ici
Le petit monde des plantes carnivores n’est peut-être pas si exclusif qu’il n’y parait et nous découvrons régulièrement de nouvelles espèces carnivores ou protocarnivores chez les plantes à fleurs. Pourtant, il y a une vingtaine d’années, des chercheurs ont émis l’hypothèse que certaines « mousses » pourraient elles aussi être carnivores. Analysons cette découverte et profitons-en pour divaguer autour de la carnivorie végétale en testant ses limites et comparant ses approches.

C’est quoi une « mousse » ?
Commençons par le commencement et par bien comprendre les plantes que l’on appelle communément « mousses ». Ces végétaux appartiennent au groupe des « Bryophytes » dont les représentants actuels sont morphologiquement et physiologiquement très proches des premiers végétaux à avoir colonisé les terres émergées il y a environ 500 millions d’années, semble-t-il avec l’aide de champignons commensalistes. Les Bryophytes n’ont pas de racines, pas de système vasculaire et ne produisent ni fleurs ni graines, elles se disséminent grâce à des spores. Parmi les Bryophytes, il existe notamment l’embranchement des Bryophyta (les « vraies » mousses) dont font parties les sphaignes que nous connaissons bien (Fig 1), ainsi que celui des Marchantiophyta, aussi appelées « hépatiques » que nous connaissons moins mais qui poussent parfois en compagnie de nos plantes carnivores en culture (Fig. 2).
Les Bryophytes ont une écologie bien différente des plantes à fleurs dont font partie toutes les plantes carnivores. Elles sont en effet extrêmement dépendantes de l’humidité directe du milieu pour leur croissance (étant donné qu’elles n’ont pas de racine) ainsi que pour leur reproduction car les gamètes mâles doivent nager dans une goutte d’eau pour rencontrer les gamètes femelles. Les Bryophytes sont souvent des espèces pionnières capables de pousser à même la roche ou le bois où les nutriments sont rares. Elles supportent généralement bien la sécheresse et peuvent se remettre en croissance rapidement une fois l’eau accessible.

Des hépatiques… carnivores ?
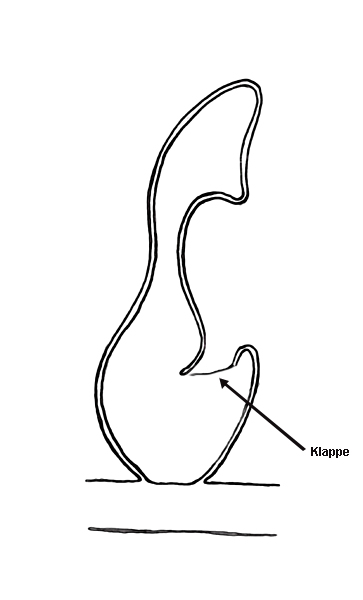
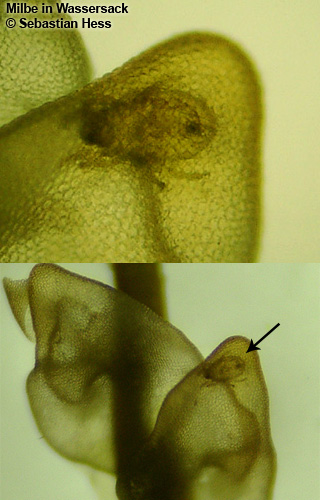
Vous avez bien lu, des hépatiques pourraient-elles être carnivores ? Deux espèces d’hépatique, Pleurozia purpurea (Fig. 3) et Colura zoophaga semblent être en mesure de capturer de petits protozoaires d’après deux études publiées en 2000 (Barthlott et al.) et 2005 (Hess et al.). Des chercheurs ont en effet mis en évidence la présence de « sacs », initialement destinés à stocker l’eau, dotés d’une petite ouverture qui ne s’ouvre que vers l’intérieur, ne permettant donc qu’une entrée et aucune sortie (Fig. 4). Ce « piège » ressemble en pratique à celui des Utricularia (mais sans mouvement) ou des Genlisea. Il semblerait aussi qu’il ne soit pas rare dans leur milieu naturel de trouver de petits protozoaires capturés à l’intérieur de ces pièges (Fig. 5). Des expérimentations en conditions contrôlées ont permis de montrer que des protozoaires étaient effectivement attirés par la plante sans que l’on arrive vraiment à comprendre comment ni pourquoi. En effet, 86% des vésicules contenaient des proies et certaines en contenaient plus de 10 ! La présence d’enzymes digestives est jugée hautement improbable par les auteurs mais n’a pas été clairement investiguée et statuée à l’heure actuelle.

Les expérimentations s’arrêtent malheureusement ici et on ne peut donc qu’émettre des hypothèses avec ces observations. La présence de ces protozoaires en milieu naturel est normale puisqu’ils se nourrissent des bactéries dégradant les parties mortes de la plante. Ils sont d’ailleurs plus nombreux sur les parties vieillissantes des mousses que sur les parties jeunes, ce qui corrobore cette hypothèse. Le mécanisme d’attraction de ces protozoaires autour des hépatiques est en revanche plus floue. Les auteurs précisent que cela peut venir du fait qu’une quantité importante de bactéries se trouve au niveau des pièges (sans que l’on ne sache pourquoi), ou bien que les protozoaires s’amoncellent autour de la plante pour se protéger de la lumière. Ces hypothèses alternatives n’ont malheureusement pas été testées. Une fois capturés, les protozoaires meurent dans les pièges mais ne semblent pas être digérés. Enfin, aucune expérience n’a été faite pour mesurer si la croissance des hépatiques était accélérée en présence de proies ou non, ce qui pose problème pour trancher la question de la carnivorie chez ces espèces. Comment souvent, nous avons plus de questions que de réponses. Mais finalement, quels sont les paramètres permettant d’affirmer qu’une plante est belle et bien « carnivore » ?
Joyeux bazar dans la carnivorie
Nous le savons bien, une plante est généralement considérée comme carnivore si elle parvient à attirer et capturer une proie, puis à la digérer afin d’en tirer des bénéfices sur sa croissance ou sa floraison, lui conférant ainsi une compétitivité et une reproduction accrues face aux autres espèces de son milieu. Le problème étant que bon nombre d’espèces considérées comme « carnivores » par les collectionneurs ne cochent pas toutes les cases. Par exemple, les Utricularia, et les Pinguicula dans une moindre mesure, ne semblent pas explicitement attirer des proies, mais comptent plutôt sur le hasard pour les piéger puis les digérer. De même, plusieurs espèces ne produisent pas d’enzymes digestives (comme certains Heliamphora) mais bénéficient tout de même de la capture de proies via des intéractions plus ou moins complexes avec d’autres espèces, notamment des bactéries. L’exemple le plus étudié étant Sarracenia purpurea qui contient tout un écosystème à l’intérieur de ses pièges permettant la dégradation des proies (Harvey & Miller, 1996).
On pourrait alors penser que le seul point commun entre toutes les plantes carnivores serait la production de feuilles extrêmement modifiées dans l’unique but de capturer des proies. Cela serait logique d’un point de vue évolutif, si la sélection naturelle a favorisé le développement de feuilles qui se détournent de leur utilité première (optimiser la captation de la lumière solaire pour la photosynthèse) au profit de la création de formes et de mécanismes complexes pour la capture d’animaux, alors nécessairement l’espèce a un penchant pour la carnivorie. Mais alors, que faire de Paepalanthus bromélioides qui est capable d’absorber les nutriments des animaux qui se noient au centre de sa rosette (Nishi et al, 2013), ou de Brocchinia reducta qui a les mêmes capacités via des glandes spécialisées (Owen et al, 1988) et qui semble en plus produire des enzymes digestives (phosphatases) en faible quantité (Płachno et al., 2006). En effet, ces deux espèces généralement considérées comme carnivores ou protocarnivores sont en tous points similaires à leurs congénères pour lesquels ces attributs n’existent pas (Fig. 6.).

La modification drastique des feuilles n’est peut-être pas nécessaire à la carnivorie, le plus important étant peut-être la finalité ultime du syndrome carnivore : récupérer les nutriments d’autres organismes pour améliorer sa compétitivité dans un milieu pauvre. Si l’on y réfléchit bien, c’est tout de même là l’intérêt de la carnivorie. Donc, si une espèce est capable d’absorber des nutriments et de les intégrer à ses tissus, elle pourrait être qualifiée de « carnivore ». Ça tombe bien, une expérience permet justement de marquer des protéines déposées à la surface des feuilles d’une plante et d’en mesurer la quantité qui intègre les tissus du végétal. Cette expérience a mené à quelques surprises. Par exemple, chez les Stylidium, les nutriments marqués ne sont pas plus absorbés par les espèces de ce genre que des espèces aléatoires – non carnivores – et le niveau d’absorption serait d’ailleurs nettement inférieur à celui des Drosera (Nge & Lambers, 2018). Autre surprise, plusieurs espèces qui sécrètent du mucilage (à la manière des plants de tomates par exemple), mais usuellement considérées comme « non carnivores » par les collectionneurs, absorbent en réalité les nutriments des proies qu’elles capturent (Spomer, 1999), faisant d’elles des plantes « davantage » carnivores que les Stylidium. En effet, d’après Spomer (1999), 13 espèces collantes sur les 17 testées sont capables de digérer des nutriments via des protéases, sans que l’on ne sache si cela apporte réellement un avantage à la plante. Dans son article, Spoomer montre que la patate (Solanum tuberosum) est carnivore, et que ses feuilles digèrent les protéines. L’intégration des protéines aux tissus de la plante n’a été testé que chez Geranium viscosissimum et Potentilla arguta et a été largement validé (Fig. 7). Ce sont donc aussi des plantes carnivores.
La digestion et l’absorption de nutriments issus de proies piégés pourraient alors être bien plus répandues qu’on ne l’imaginait chez les plantes collantes. Il est pourtant largement admis que le mucilage sert avant tout de protection faces aux phytophages. Ces espèces pourraient alors faire d’une pierre deux coups en se protégeant des ravageurs tout en absorbant les nutriments de ceux qui se font piéger, démontrant ainsi une piste plausible de l’évolution des mécanismes de capture des pièges à glu. Mais une question demeure, si la plante ne tire pas de bénéfices notables sur sa compétitivité, peut-on vraiment parler de carnivorie ? En effet, ces espèces ne semblent pas pousser sur des milieux spécialement pauvres (Chase et al., 2009).

Il est clairement plus compliqué que prévu de déterminer si une plante peut être considérée comme « carnivore » ou non, et nous ne nous attarderons même pas sur le terme de « protocarnivore » qui englobe un peu tout et n’importe quoi sans consensus claire. Un autre exemple pour continuer à vous casser le cerveau si vous aviez encore des certitudes à propos de la définition de la carnivorie végétale. L’espèce Capsella bursa-pastoris (ou la bourse-à-Pasteur, une jolie Brassicaceae qui pousse probablement près de chez vous et qui produit des siliques en forme de cœur) produit des graines qui semblent pouvoir créer du mucilage une fois au contact de l’eau afin de piéger de petits nématodes (Fig. 8), permettant ainsi aux graines de mieux germer et d’accumuler plus de réserves, et aux plantules de développer des feuilles plus grandes (Roberts et al., 2018). Cette capacité semble facultative puisqu’elle n’est observée que quand les sols sont pauvres en nutriments. La plante en soit n’est donc pas carnivore, sa graine en revanche semble pouvoir l’être mais uniquement dans certaines conditions. Peut-on alors considérer l’espèce comme carnivore ?

On commence là à s’éloigner de la dionée qui semble calibrée pour capturer et digérer des proies, pourtant il ne semble pas y avoir de différences fondamentales sur le principe entre la graine de la bourse-à-Pasteur et la dionée. Néanmoins, toutes les plantes ne sont pas carnivores, malgré le fait qu’elles puissent « capturer » ou plutôt tuer des animaux, quoiqu’en disent les informations qui circulent sur les réseaux sociaux. Prenons l’exemple de Puya raimondii, la reine des Andes, que j’ai eu la chance d’observer dans son milieu naturel dans les hauts-plateaux boliviens (Fig. 9). Cette espèce majestueuse a souvent été suspectée de carnivorie (ou de protocarnivorie) à cause d’intéractions qu’elle aurait avec des oiseaux, ou le fait qu’elle puisse tuer des animaux (Rees & Roe, 1980). Des photos montrent même des chats sauvages morts entortillés dans ses feuilles (je vous laisse chercher le lien dans les références). Cette hypothèse stipule que les déjections des oiseaux et les animaux morts piégés dans ses feuilles épineuses enrichissent le sol une fois dégradés, permettant ainsi une meilleure croissance de la plante.
Pourquoi cette hypothèse, néanmoins séduisante, reste bancale ? Tout d’abord il faut savoir que cette espèce pousse sur les hauts plateaux andins à plus de 4’000 mètres d’altitude, dans un climat particulier où les gelées sont courantes la nuit et le soleil est brûlant durant la journée. Les précipitations sont rares et le sol plutôt pauvre ce qui rend difficile la dégradation de la matière organique (on observe le même phénomène dans les sols de nos montagnes). Difficile donc a priori d’imaginer une transformation efficace des animaux piégés par la plante en nutriments absorbables même au terme de sa longue vie. La végétation dominante appelée « pampa » est composée quasiment exclusivement de graminées dépassant rarement les quelques dizaines de centimètre de hauteur. La plante suspectée de carnivorie peut en revanche atteindre 15 mètres de haut en floraison et représente souvent l’unique point en hauteur du paysage. Elle pourrait alors faire office de perchoir, expliquant ainsi la présence des oiseaux. De plus, les épines et la dureté de ses feuilles sont des syndromes récurrents de protection face aux herbivores, surtout dans un milieu où l’eau est rare et les graminées peu appétissantes. Le fait que des animaux se retrouvent piégés dans ses feuilles montre en réalité à quel point cette défense est efficace. Cela explique aussi pourquoi les oiseaux viennent nidifier à l’intérieur de celles-ci puisqu’elles offrent une protection diablement efficace face aux prédateurs. D’ailleurs, on peut penser que les chats retrouvés morts venaient chasser les oiseaux réfugiés à l’intérieur de la plante, qui leur a sauvé la vie. Dans cette situation, on ne peut donc pas parler de carnivorie mais simplement de mécanismes de défense face aux herbivores.

Trier les syndromes carnivores et la carnivorie
Il est toujours très compliqué de ranger les éléments naturels dans des cases bien définies et le cas de la carnivorie ne fait pas exception. Nous n’avons même pas parlé ici des espèces pouvant dégrader des végétaux (Nepenthes ampullaria), qui s’apparenteraient en toutes logiques à des plantes « herbivores », ou des espèces ayant des intéractions bien spécifiques avec des animaux pour tirer des nutriments de leurs déjections, que l’on pourrait appeler plantes « détritivores », pour rester poli (on en avait déjà parlé dans cet article). Il est très important de se rappeler que, comme toujours, il y a des intermédiaires, des exceptions et que tout est une question de nuances et de définition. Une plante est-elle « carnivore » si seulement sa graine arrive à tirer des bénéfices de la capture d’animaux, uniquement dans des conditions bien particulières ? Une plante est-elle « carnivore » si elle arrive à absorber les nutriments de ses proies sans pour autant en tirer un bénéfice notable sur sa croissance ? Une plante est-elle « protocarnivore » si elle ne digère pas elle-même les proies qu’elles capturent mais qu’elle tire des bénéfices notables sur sa croissance grâce à l’intervention de bactéries ou d’animaux ?
C’est compliqué, et à chacun de se faire son avis. Et en parlant d’avis, voici le résultat d’un sondage qui cherchait à déterminer, selon les utilisateurs d’un groupe Facebook, quelles propositions pouvaient définir une plante carnivore (Fig. 10). Les utilisateurs pouvaient voter pour plusieurs réponses simultanément car elles ne sont pas exclusives pour la plupart. Pourtant on voit que la réponse la plus sélectionnée peine tout de même à réunir un tier des 86 votants, ce qui montre qu’il n’y a pas vraiment de consensus, même au sein de la communauté (sinon elle aurait été proche de 100%). Les critères qui semblent particulièrement importants reposent sur les bénéfices tirés de l’absorption des nutriments des proies et la sécrétion d’enzymes digestives, les autres réponses ne convenant pas à plus d’une personne sur cinq.
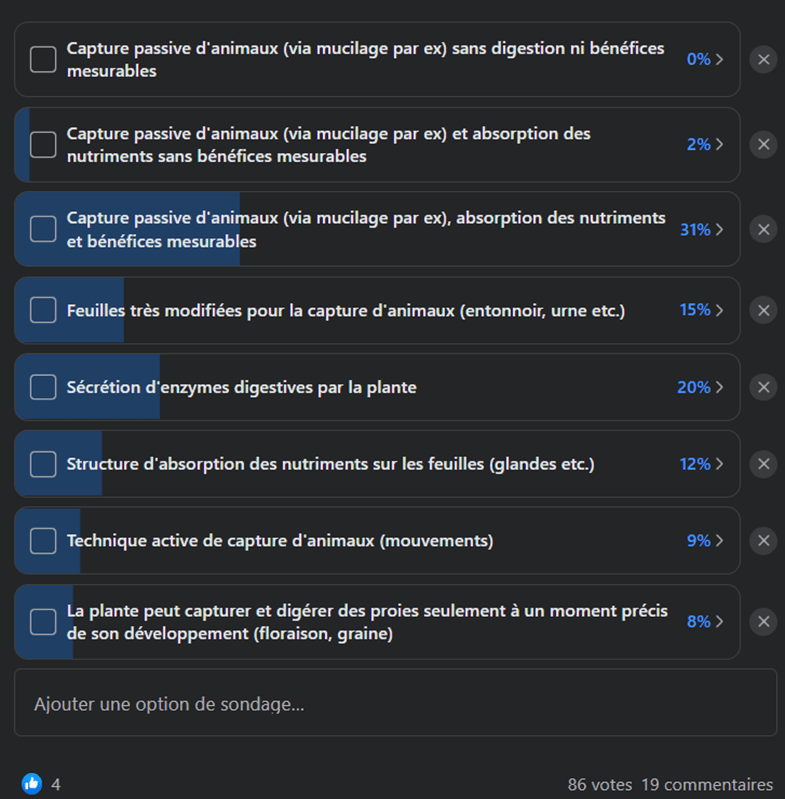
La sélection au cours de l’évolution de l’habilité à sécréter des enzymes digestives semble être un réel syndrome carnivore, sinon il est difficile de l’expliquer. De même, la finalité de la carnivorie est de tirer des bénéfices sur la compétitivité des individus en absorbant plus de nutriments que ses voisins. Pourtant, plusieurs espèces ne produisent pas d’enzymes digestives mais bénéficient pour autant de la capture de leurs proies, alors comment définir clairement la carnivorie ?
Pour tenter de terminer sur une note plus constructive que « c’est compliqué », quelques auteurs ont tenté des définitions avec à chaque fois des points forts et des points faibles. Certains séparent la « vraie » carnivorie intégrant l’absorption de nutriments issus de proies, de la « zoophagie » qui ne s’applique qu’aux plantes capables de capturer des animaux peu importe la raison profonde (ce qui s’apparenterait à un caractère « protocarnivore »), sans considérer le gain de compétitivité. Certains auteurs parlent aussi de carnivorie « active » et « passive » en fonction de l’intensité des mécanismes mis à disposition par la plante pour tirer des bénéfices de ses proies sans tracer une délimitation claire entre les deux. D’autres évoquent le terme de « plantes meurtrières » pour les regrouper toutes sous un même terme sans chercher de définition précise à la carnivorie (Chase et al., 2009). Enfin, d’autres partent du principe que la sécrétion d’enzymes digestives est l’unique critère permettant de définir si une plante est carnivore ou non, ce qui a le mérite d’être clair, mais reste discutable. En effet, Sarracenia purpurea n’est donc pas carnivore selon cette définition alors même que ses feuilles sont extrêmement modifiées pour capturer des proies et absorber leurs nutriments. On peut alors se demander si la modification des feuilles est réellement un attribut carnivore contrairement à la sécrétion d’enzymes digestives et on retombe sur les premières réflexions… C’est un peu le serpent qui se mord la queue.
D’un point de vue purement personnel, et ce qui suit n’engage que moi, je trouve intéressant de considérer la carnivorie non pas comme un critère binaire (« carnivore » ou « non carnivore ») mais plutôt comme une échelle, une nuance ou une graduation, en fonction des mécanismes mis en place par la plante et de sa dépendance aux proies. Il n’y aurait donc pas de limite claire entre une plante « carnivore » et une qui ne le serait pas, juste des niveaux de carnivorie (ou de « syndrome carnivore ») plus ou moins élevés qui reflètent en quelque sorte l’intensité de la carnivorie d’un point de vu évolutif. Voici une ébauche :
- 0 = Pas de syndrome carnivore.
- 1 = Mécanismes de défense face aux herbivores tel que le mucilage, ou mécanismes entraînant la mort d’animaux sans absorption des nutriments (Plumbago capensis par exemple, Fig. 11). On peut considérer les plantes de ce niveau comme « zoophages ».
- 2a = Absorption claire de nutriments issus de la capture de proies sans mécanisme dédié et sans avantage clair sur les autres espèces du milieu. A priori, je n’ai pas trouvé de plantes capables d’absorber des nutriments sans mécanismes dédiés (glandes, poils etc.), cela peut être le cas chez Geranium viscosissimum ou Paepalanthus bromelioides mais ça n’a pas été clairement investigué.
- 2b = Absorption claire de nutriments issus de proies via des glandes spécialisées ou autre mécanisme dédié sans avantage clair sur les autres espèces du milieu (Brocchinia reducta peut faire partie de ce niveau de carnivorie ou du suivant, je ne crois pas que l’amélioration de la compétitivité ait été démontrée). On pourrait parler de protocarnivorie pour l’ensemble du niveau 2.
- 3 = Avantage compétitif et/ou reproductif démontré à l’absorption de nutriments issus de proies (Capsella bursa-pastoris et ses graines carnivores). Les espèces de ce niveau seraient alors « faiblement carnivores ».
- 4 = Organes nettement modifiés pour l’attraction et/ou la capture de proies indiquant une évolution franche vers la carnivorie ; absorption des nutriments entrainant une augmentation de la compétitivité (Sarracenia, Nepenthes, etc.). Ce niveau et le suivant regroupent ce que l’on appelle communément les plantes « carnivores ».
- 5 = Mêmes syndromes que le point 4 mais avec en plus des modifications physiologiques complexes facilitant la carnivorie, par exemple la présence de mouvements favorisant la capture ou la digestion (Drosera, Utricularia, Dionaea etc.). Les espèces de ce niveau seraient alors « très carnivores ».

Concluons
Toutes ces réflexions sur la carnivorie sont très théoriques et aucune n’est tout à fait satisfaisante pour l’ensemble des végétaux concernés. Dans l’échelle proposée, l’hypothèse de départ stipule que la sécrétion d’enzymes digestives ou la digestion des proies via des agents externes (bactéries) sont des mécanismes similaires puisqu’ils amènent à une même finalité qui est l’absorption de nutriments. Cette hypothèse est discutable mais néanmoins logique dans le sens où une espèce n’a pas « besoin » de développer tout un métabolisme de sécrétion d’enzymes digestives si le travail de digestion est déjà fait par d’autres organismes. De plus, des espèces de niveau 1 ou 2 dans l’échelle proposée semble en mesure de sécréter des protéases, mais il n’est pas très clair si ces enzymes proviennent bel et bien de la plante ou de bactéries à la surface de ses organes.
Pour en revenir à nos hépatiques (vous vous souvenez ?), il est difficile de les qualifier de « carnivores » à l’heure actuelle vu que nous ne savons pas si elles absorbent les nutriments de leurs proies et si elles en tirent un avantage compétitif. Elles sont à minima « zoophage » (au niveau 1 de l’échelle) mais peuvent tout à fait se retrouver au niveau 4 s’il est démontré qu’elles peuvent absorber les nutriments induisant des bénéfices nets sur leur compétitivité, étant donné qu’elles possèdent des organes qui semblent dédiés à la capture d’animaux.
Pour conclure, il est tout de même intéressant de noter que si des espèces très ancestrales ou « primitives » comme des mousses (ne dîtes jamais ça à un/e bryologue) ont des capacités d’attraction et de capture d’animaux, alors la carnivorie chez les plantes a pu potentiellement évoluer depuis le tout début de la colonisation des terres par les végétaux, ce qui expliquerait qu’elle soit apparu au moins une dizaine de fois au cour de l’évolution de manière tout à fait indépendante rien que chez les plantes à fleurs, qui sont relativement récentes. Pour aller plus loin dans ces réflexions, il nous manque avant tout des recherches dans le domaine pour mieux « classifier » la carnivorie en fonction des attributs des plantes. Il faudrait plus largement investiguer la présence de structures spécialisées dans l’absorption de nutriments, la capacité des plantes à intégrer les nutriments des proies dans leurs tissus et les potentiels bénéfices sur leur croissance et reproduction pour avoir un avis plus éclairé sur bon nombre d’entre-elles. D’un point de vue évolutif, il serait intéressant d’étudier si la sécrétion d’enzymes digestives est un attribut antérieur à la modification des feuilles, ou au contraire un caractère plus « compliqué » à mettre en place et donc réservé à des plantes franchement carnivores. Quoi qu’il en soit, le petit monde des plantes carnivores semble avoir des limites floues et pourrait tout à fait inclure tout un tas de nouvelles espèces, au plus grand bonheur des collectionneurs.
Pour aller plus loin
Un article scientifique qui traite de la carnivorie d’une bonne partie des plantes citées dans cette article.
https://academic.oup.com/botlinnean/article/161/4/329/2418471
Un article sur les hépatiques carnivores avec des illustrations et des photos que je n’ai pas pu utiliser dans cet article :
https://www.indefenseofplants.com/blog/2016/1/22/zoophagous-liverworts
Bibliographie
Barthlott, W., Fischer, E., Frahm, J. P., & Seine, R. (2000). First experimental evidence for zoophagy in the hepatic Colura. Plant Biology, 2(01), 93-97. https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-2000-9150
Chase, M. W., Christenhusz, M. J., Sanders, D., & Fay, M. F. (2009). Murderous plants: Victorian Gothic, Darwin and modern insights into vegetable carnivory. Botanical Journal of the Linnean Society, 161(4), 329-356. https://academic.oup.com/botlinnean/article/161/4/329/2418471
Chat capturé par Puya raimondii : https://www.degruyter.com/document/doi/10.1515/mamm.1977.41.2.231/html
Harvey, E., & Miller, T. E. (1996). Variance in composition of inquiline communities in leaves of Sarracenia purpurea L. on multiple spatial scales.Oecologia, 108(3), 562-566.
Hess, S., Frahm, J. P., & Theisen, I. (2005). Evidence of zoophagy in a second liverwort species, Pleurozia purpurea. The Bryologist, 108(2), 212-218. https://bioone.org/journals/the-bryologist/volume-108/issue-2/6/Evidence-of-Zoophagy-in-a-Second-Liverwort-Species-Pleurozia-purpurea/10.1639/6.short
Sanguet, 2014. Les intéractions plantes-animaux chez les plantes carnivores. Phagophytos : https://phagophytos.com/2014/11/29/les-interactions-plantes-insectes-chez-les-plantes-carnivores/
Nge, F. J., & Lambers, H. (2018). Reassessing protocarnivory–how hungry are triggerplants?. Australian Journal of Botany, 66(4), 325-330. https://www.publish.csiro.au/BT/BT18059
Nishi, A. H., Vasconcellos-Neto, J., & Romero, G. Q. (2013). The role of multiple partners in a digestive mutualism with a protocarnivorous plant. Annals of Botany, 111(1), 143-150. https://academic.oup.com/aob/article/111/1/143/182710
Owen Jr, T. P., Benzing, D. H., & Thomson, W. W. (1988). Apoplastic and ultrastructural characterizations of the trichomes from the carnivorous bromeliad Brocchinia reducta. Canadian journal of botany, 66(5), 941-948. https://cdnsciencepub.com/doi/abs/10.1139/b88-136
Płachno, B. J., Adamec, L., Lichtscheidl, I. K., Peroutka, M., Adlassnig, W., & Vrba, J. (2006). Fluorescence labelling of phosphatase activity in digestive glands of carnivorous plants. Plant Biology, 8(06), 813-820. https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-2006-924177
Rees, W. E., & Roe, N. A. (1980). Puya raimondii (Pitcairnioideae, Bromeliaceae) and birds: an hypothesis on nutrient relationships. Canadian Journal of Botany, 58(11), 1262-1268. https://cdnsciencepub.com/doi/abs/10.1139/b80-157
Roberts, H. R., Warren, J. M., & Provan, J. (2018). Evidence for facultative protocarnivory in Capsella bursa-pastoris seeds. Scientific Reports, 8(1), 1-5. https://www.nature.com/articles/s41598-018-28564-x
Stoltzfus, A., Suda, J., Kettering, R., Wolfe, A., & Williams, S. (2002). Secretion of digestive enzymes in Plumbago. In Proceedings: The 4th International Carnivorous Plant Conference (pp. 203-207). https://www.musekautas.lt/wp-content/uploads/2017/05/ICPS2002confp203_207.pdf
Spomer, G. G. (1999). Evidence of protocarnivorous capabilities in Geranium viscosissimum and Potentilla arguta and other sticky plants. International Journal of Plant Sciences, 160(1), 98-101. https://www.journals.uchicago.edu/doi/full/10.1086/314109?casa_token=OClq_tXLLloAAAAA%3Ac3bEmssqa3wS7Lub9gp8Qtc4XsZSUCoMGw4vpr-xz6b13Ypc-rHAQElRx3fx4b6WC8IOARmy-y3X
